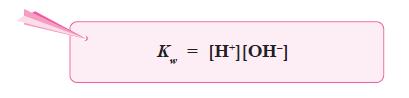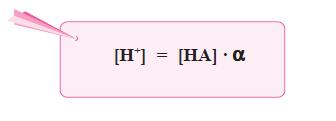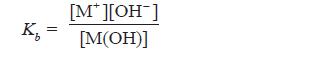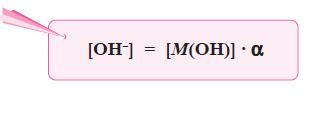Asam dan basa sudah dikenal sejak zaman dulu. Istilah asam (acid)
berasal dari bahasa Latin acetum yang berarti cuka. Istilah basa
(alkali) berasal dari bahasa Arab yang berarti abu. Basa digunakan dalam
pembuatan sabun. Juga sudah lama diketahui bahwa asam dan basa saling
menetralkan. Di alam, asam ditemukan dalam buah-buahan, misalnya asam
sitrat dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Cuka mengandung asam asetat, dan asam tanak dari kulit pohon digunakan
untuk menyamak kulit. Asam mineral yang lebih kuat telah dibuat sejak
abad pertengahan, salah satunya adalah aqua forti (asam nitrat) yang
digunakan oleh para peneliti untuk memisahkan emas dan perak.

Pada tahun 1884, Svante Arrhenius (1859-1897) seorang ilmuwan Swedia
yang memenangkan hadiah nobel atas karyanya di bidang ionisasi,
memperkenalkan pemikiran tentang senyawa yang terpisah atau terurai
menjadi bagian ion-ion dalam larutan. Dia menjelaskan bagaimana kekuatan
asam dalam larutan aqua (air) tergantung pada konsentrai ion-ion
hidrogen di dalamnya.
Menurut Arrhenius,
asam adalah zat yang dalam air melepakan ion H+, sedangkan
basa adalah zat yang dalam air melepaskan ion OH–. Jadi pembawa sifat asam adalah ion
H+, sedangkan pembawa sifat basa adalah ion
OH–. Asam Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai berikut.
HxZ ⎯⎯→ x H+ + Zx–
Jumlah ion H+ yang dapat dihasilkan oleh 1 molekul asam disebut
valensi asam, sedangkan ion negatif yang terbentuk dari asam setelah melepaskan ion H+ disebut
ion sisa asam. Beberapa contoh asam dapat dilihat pada tabel 5.1.
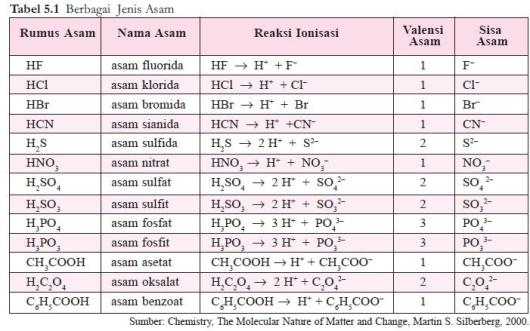
Basa Arrhenius adalah hidroksida logam, M(OH)x, yang dalam air terurai sebagai berikut.
M(OH)x ⎯⎯→ Mx+ + x OH–
Jumlah ion OH– yang dapat dilepaskan oleh satu molekul basa disebut valensi basa. Beberapa contoh basa diberikan pada tabel 5.2.
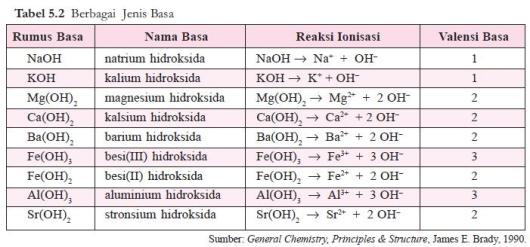
Asam sulfat dan magnesium hidroksida dalam air mengion sebagai berikut.
H2SO4 ⎯⎯→ 2 H+ + SO42–
Mg(OH)2 ⎯⎯→ Mg+ + 2 OH–
 Persamaan ionisasi air dapat ditulis sebagai:
Persamaan ionisasi air dapat ditulis sebagai:
H2O(l) ←⎯⎯⎯⎯→ H+(aq) + OH–(aq)
- Harga tetapan air adalah:

- Konsentrasi H2O yang terionisasi menjadi H+ dan OH– sangat kecil
dibandingkan dengan konsentrasi H2O mula-mula, sehingga konsentrasi H2O
dapat dianggap tetap, maka harga K[H2O] juga tetap, yang disebut tetapan
kesetimbangan air atau ditulis Kw.
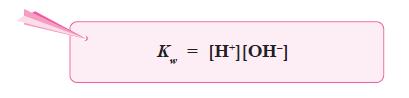
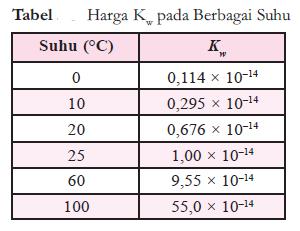
- Pada suhu 25 °C, Kw yang didapat dari percobaan adalah 1,0 × 10–14.
- Harga Kw ini tergantung pada suhu, tetapi untuk percobaan yang
suhunya tidak terlalu menyimpang jauh dari 25 °C, harga Kw itu dapat
dianggap tetap.
- Harga Kw pada berbagai suhu dapat dilihat pada tabel berikut.



Kekuatan asam dipengaruhi oleh banyaknya ion – ion H+ yang dihasilkan
oleh senyawa asam dalam larutannya. Berdasarkan banyak sedikitnya ion H+
yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
1. Asam Kuat
Asam kuat yaitu senyawa asam yang dalam larutannya terion seluruhnya
menjadi ion-ionnya. Reaksi ionisasi asam kuat merupakan reaksi
berkesudahan. Secara umum, ionisasi asam kuat dirumuskan sebagai berikut.
HA(aq) ⎯⎯→ H+(aq) + A–(aq)

2. Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannya hanya sedikit
terionisasi menjadi ion-ionnya. Reaksi ionisasi asam lemah merupakan reaksi
kesetimbangan.
Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan
sebagai berikut.
HA(aq) ←⎯⎯⎯⎯→ H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke
kanan, akibatnya Ka bertambah besar. Oleh karena itu, harga Ka merupakan
ukuran kekuatan asam, makin besar Ka makin kuat asam.
Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–],
maka persamaan di atas dapat diubah menjadi:

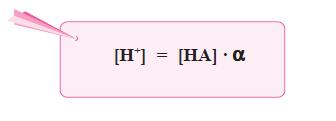


- Kekuatan basa dipengaruhi oleh banyaknya ion – ion OH– yang dihasilkan oleh senyawa basa dalam larutannya.
- Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
1. Basa Kuat
- Basa kuat yaitu senyawa basa yang dalam larutannya terion seluruhnya
menjadi ion-ionnya. Reaksi ionisasi basa kuat merupakan reaksi
berkesudahan.
- Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(aq) ⎯⎯→ Mx+(aq) + x OH–(aq)
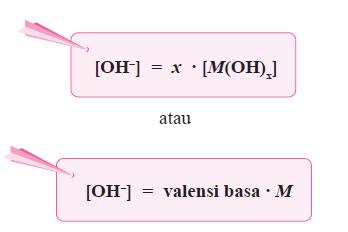
dengan: x = valensi basa
M = konsentrasi basa
2. Basa Lemah
- Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit terionisasi menjadi ion-ionnya.
- Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
- Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M(OH)(aq) ←⎯⎯⎯⎯→ M+(aq) + OH–(aq)
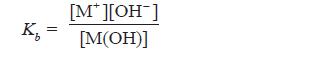
- Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambahbesar.
- Oleh karena itu, harga Kb merupakan ukuran kekuatan basa, makin besar Kb makin kuat basa.
- Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:

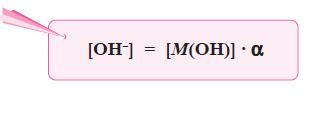


- Untuk menyatakan tingkat atau derajat keasaman suatu larutan, pada
tahun 1910, seorang ahli dari Denmark, Soren Lautiz Sorensen
memperkenalkan suatu bilangan yang sederhana.
- Billangan ini diperoleh dari hasil logaritma konsentrasi H+.
- Bilangan ini kita kenal dengan skala pH. Harga pH berkisar antara 1 – 14 dan ditulis:

- Dari uraian di atas dapat kita simpulkan bahwa:
a. Larutan bersifat netral jika [H+] = [OH–] atau pH = pOH = 7.
b. Larutan bersifat asam jika [H+] > [OH–] atau pH < 7.
c. Larutan bersifat basa jika [H+] < [OH–] atau pH > 7.
- Karena pH dan konsentrasi ion H+ dihubungkan dengan tanda negatif,
maka makin besar konsentrasi ion H+ makin kecil pH, dan karena bilangan
dasar logaritma adalah 10, maka larutan yang nilai pH-nya berbeda
sebesar n mempunyai perbedaan ion H+ sebesar 10n.
- Perhatikan contoh di bawah ini.
- Jika konsentrasi ion H+ = 0,01 M, maka pH = – log 0,01 = 2
- Jika konsentrasi ion H+ = 0,001 M (10 kali lebih kecil) maka pH = – log 0,001 = 3 (naik 1 satuan)
- Jadi dapat disimpulkan:
• Makin besar konsentrasi ion H+ makin kecil pH
• Larutan dengan pH = 1 adalah 10 kali lebih asam daripada larutan dengan pH = 2.

- Untuk menentukan pH suatu larutan dapat dilakukan dengan beberapa cara, antara lain sebagai berikut.
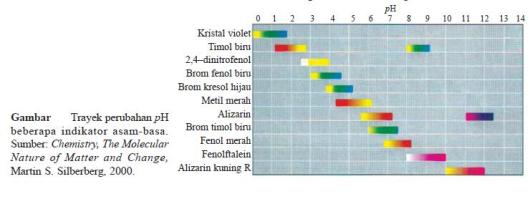
1. Menggunakan Beberapa Indikator
- Indikator adalah asam organik lemah atau basa organik lemah yang
dapat berubah warna pada rentang harga pH tertentu (James E. Brady,
1990).
- Harga pH suatu larutan dapat diperkirakan dengan menggunakan trayek pH indikator.
- Indikator memiliki trayek perubahan warna yang berbeda-beda.
- Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan.
- Contoh, suatu larutan dengan brom timol biru (6,0– 7,6) berwarna
biru dan dengan fenolftalein (8,3–10,0) tidak berwarna, maja pH larutan
itu adalah 7,6–8,3.
- Hal ini disebabkan jika brom timol biru berwarna biru, berarti pH
larutan lebih besar dari 7,6 dan jika dengan fenolftalein tidak
berwarna, berarti pH larutan kurang dari 8,3.

Konsep Asam-Basa Bronsted dan Lowry
- Menurut Bronsted dan Lowry, asam adalah spesi yang memberi proton,
sedangkan basa adalah spesi yang menerima proton pada suatu reaksi
pemindahan proton.

- Perhatikan contoh berikut.
NH
4 + (aq) + H
2O
(l) ⎯→ NH
3(aq) + H
3O
+(aq)
asam basa
H
2O
(l) + NH
3(aq) ⎯⎯→ NH
4+(aq) + OH
–(aq)
asam basa
- Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (donor proton) dan sebagai basa (akseptor proton).
- Zat seperti itu bersifat amfiprotik (amfoter).
- Konsep asam-basa dari Bronsted-Lowry ini lebih luas daripada konsep asam-basa Arrhenius karena hal-hal berikut :
- Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air,
tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan
reaksi tanpa pelarut.
- Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga
dapat berupa kation atau anion. Konsep asam-basa ronsted-Lowry dapat
menjelaskan sifat asam dari NH4Cl. Dalam NH4Cl, yang bersifat asam
adalah ion NH4+ karena dalam air dapat melepas proton.
Asam dan Basa Konjugasi
- Suatu asam setelah melepas satu proton akan membentuk spesi yang disebut basa konjugasi dari asam tersebut.
- Sedangkan basa yang telah menerima proton menjadi asam konjugasi.
- Perhatikan tabel berikut.

- Pasangan asam-basa setelah terjadi serah-terima proton dinamakan asam-basa konjugasi.

Konsep Asam-Basa LEWIS
Asam menurut Lewis adalah zat yang dapat menerima pasangan electron (akseptor pasangan electron)
Basa menurut Lewis adalah zat yang dapat memberikan pasangan electron (donor pasangan electron).
Lewis mengamati bahwa molekul BF
3 juga dapat berperilaku seperti halnya asam (H+) sewaktu bereaksi dengan NH
3. Molekul BF
3 dapat menerima sepasang elektron dari molekul NH
3 untuk membentuk ikatan kovalen antara B dan H.
Teori asam basa Lewis lebih luas dibandingkan Arhenius dan Bronsted Lowry , karena :
- Teori Lewis dapat menjelaskan reaksi asam basa yang berlangsung
dalam pelarut air, pelarut bukan air, dan tanpa pelarut sama sekali.
- Teori Lewis dapat menjelaskan reaksi asam basa yang tidak melibatkan transfer proton (H+), seperti reaksi antara BF3 dan NH3.
Contoh :
Tunjukkan bagaimana reaksi asam basa antara larutan HCl dan NaOH
menurut teori Arhenius dapat dijelaskan dengan menggunakan teori Lewis
Reaksi antara larutan HCl dan NaOH ;
HCl
(aq) + NaOH
(aq) ↔ NaCl
(aq) + H
2O
(l)
Untuk menjelaskan reaksi ini menggunakan teori Lewis, nyatakan reaksi sebagai reaksi ion:
HCl ↔ H
+ + Cl
- NaOH ↔ Na
+ + OH
-
NaCl ↔ Na
+ + Cl
- H
2O
Reaksi ion bersihnya adalah :
H
+ + OH
-↔ H
2O(l